IHC・ISH試薬 Molecular Diagnostics Division
保管温度2〜8℃
用手法用 ヒストステイナー用
ヒストファイン HER2キット(POLY)HER2(POLY)
製造販売認証/承認番号:21400AMZ00552000
■使用目的:組織、細胞中のHER2/neu遺伝子産物の検出(悪性腫瘍の診断補助等)
■資料
技術情報
スクロールで確認できます→
用手法用
ヒストステイナー用
ヒストステイナーAT用
※弊社へお問い合わせください
構成試薬
用手法用[+]
スクロールで確認できます→
| 構成試薬 | 成分 | 包装 | |
|---|---|---|---|
| 20テスト | 40テスト | ||
| ブロッキング試薬Ⅰ | 過酸化水素水 | 4mL×1本 | 4mL×2本 |
| 第一抗体 | 抗ヒトHER2/neu遺伝子産物ポリクローナル抗体(動物種:ウサギ) | 2mL×1本 | 2mL×2本 |
| 陰性コントロール | ウサギイムノグロブリン | 2mL×1本 | 2mL×2本 |
| 酵素・第二抗体標識ポリマー | ペルオキシダーゼ標識抗ウサギIgGポリクローナル抗体(Fab’) (動物種:ヤギ) | 4mL×1本 | 4mL×2本 |
| 発色基質 | 3,3’-ジアミノベンジジン・4HCl | 0.4mL×1本 | 0.4mL×2本 |
| 発色試薬 | 過酸化水素水 | 10mL×1本 | 10mL×2本 |
| 濃縮抗原賦活化液 | 100mL×2本 | 100mL×4本 | |
| PBS | リン酸緩衝液(洗浄用 10倍濃縮液) | 250mL×6本 | 250mL×12本 |
|
コントロールスライド※1 ホルマリン固定パラフィン包埋細胞株2種類を貼付したスライド ・陽性コントロールスライド(HER2/neu タンパク発現量:3+) ・陰性コントロールスライド(HER2/neu タンパク発現量:0) /スライド |
|||
| 付属品 | |||
| 目盛り付き試験管 | 1本 | 2本 | |
| ※1:コントロールスライドは、本キットの構成試薬として販売していないので、別売りの研究用試薬「ヒストファイン HER2 コントロールスライド」を使用すること。 | |||
ヒストステイナー用[+]
スクロールで確認できます→
| 構成試薬 | 成分 | 包装 |
|---|---|---|
| ブロッキング試薬Ⅰ | 過酸化水素水 | 8mL×2本 |
| 第一抗体 | 抗ヒトHER2/neu遺伝子産物ポリクローナル抗体(動物種:ウサギ) | 8mL×1本 |
| 陰性コントロール | ウサギイムノグロブリン | 8mL×1本 |
| 酵素・第二抗体標識ポリマー | ペルオキシダーゼ標識抗ウサギIgGポリクローナル抗体(Fab’) (動物種:ヤギ) | 8mL×2本 |
| 発色基質 | 3,3’-ジアミノベンジジン・4HCl | 1.6mL×2本 |
| 発色試薬 | 過酸化水素水 | 40mL×2本 |
| 濃縮抗原賦活化液※1 | 100mL×4本 | |
| PBS※2 | リン酸緩衝液(洗浄用 10倍濃縮液) | - |
|
コントロールスライド※3 ホルマリン固定パラフィン包埋細胞株2種類を貼付したスライド ・陽性コントロールスライド(HER2/neu タンパク発現量:3+) ・陰性コントロールスライド(HER2/neu タンパク発現量:0) /スライド |
||
| 付属品 | ||
| 目盛り付き試験管 | 1本 | |
| 基質溶液用ボトル | 2本 | |
|
※1:濃縮抗原賦活化液の替わりに研究用試薬「HEAT PROCESSOR Solution pH6 コード:715281」を使用してもよい。 ※2:PBS は、本キットの構成品として販売していないので、研究用試薬「PBS(ヒストステイナー用)コード:715224」を使用すること。 ※3:コントロールスライドは、本キットの構成品として販売していないので、別売りの研究用試薬「HER2 コントロールスライド」を使用すること。 |
||
測定原理
HER2※/neu遺伝子は1986年に山本らにより発見され、その遺伝子配列が決定された1)。この遺伝子産物であるHER2/neuタンパクは、チロシンキナーゼ活性を有する分子量185kDaの細胞膜貫通型受容タンパクであり、乳癌、前立腺癌および胃癌の組織において高頻度にタンパク過剰発現、あるいは遺伝子増幅していることが報告されている2) , 3)。特に、HER2/neuタンパクの過剰発現、あるいは遺伝子増幅が認められた乳癌患者は、予後が不良であることが多いと報告されている4)。このため米国で、癌細胞に発現されたHER2/neuタンパクを標的としてヒト化されたモノクローナル抗体 ハーセプチン(トラスツズマブ。ジェネンテック社)がHER2過剰発現の転移性乳癌の抗体治療薬として開発され、1998年に米国食品衛生局(FDA)から承認された。日本においても2001年、「HER2/neuタンパク過剰発現が確認された転移性乳癌」の抗体治療薬としてハーセプチン(中外製薬株式会社)が発売された。その後、2008年には、「HER2/neuタンパク過剰発現が確認された乳癌における術後補助化学療法」の効能・効果で承認された。更に、2011年3月に、「HER2/neuタンパクの過剰発現、あるいは遺伝子増幅が認められた治療切除不能な進行・再発の胃癌」の治療薬として適用拡大された。HER2/neuタンパクの過剰発現あるいは遺伝子増幅の有無を知ることが治療上必要不可欠となった。
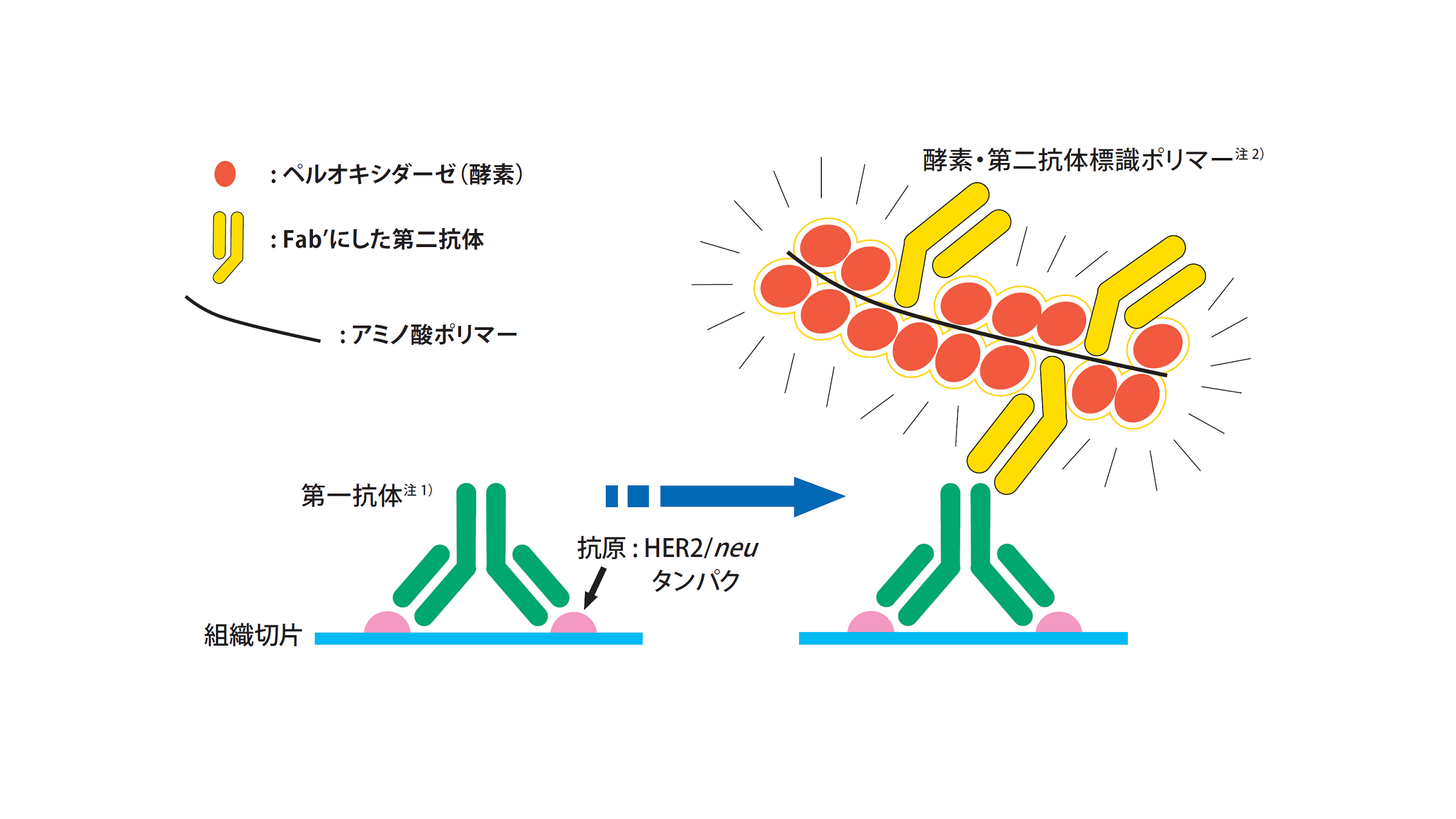
本品は、免疫組織化学染色法を用いて腫瘍細胞中のHER2/neu遺伝子産物(HER2/neuタンパク抗原)を検出し、そのタンパクの過剰発現の有無を判定する。
最初に、腫瘍細胞中のHER2/neuタンパク抗原に対する特異的な第一抗体注1)を反応させ、次にアミノ酸ポリマーに酵素と第二抗体を結合させた試薬である酵素・第二抗体標識ポリマー注2)を反応させる。その結果、抗原・抗体・ポリマー・酵素の複合体を形成させ、この複合体の酵素活性を利用して基質を発色させる。これにより抗原部位を視覚化し、光学顕微鏡により抗原の有無を確認する。
※:HER2 : Human Epidermal Growth Factor Receptor Type2
注1) 第一抗体:抗ヒトHER2/neu遺伝子産物ポリクローナル抗体(動物種:ウサギ)
注2) 酵素・第二抗体標識ポリマー:ペルオキシダーゼ標識抗ウサギIgGポリクローナル抗体 (Fab') (動物種:ヤギ)
臨床的有用性
乳癌や胃癌などの腫瘍においてHER2/neu遺伝子の増幅あるいはHER2タンパクの過剰発現が報告されており、HER2をターゲットとした分子標的治療の適応を決定する上で、HER2/neu遺伝子増幅の有無やHER2タンパクの過剰発現を知ることはとても重要です。
文献
1) Yamamoto T, et al. Similarity of protein encoded by the human c-erb B-2 gene to epidermal growth factor receptor. Nature. 1986 Jan 16-22;319(6050):230-4.
2) Slamon DJ, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 Jan 9;235(4785):177-82.
3) Yamada Y, et al. Association of elevated expression of the c-erbB-2 protein with spread of breast cancer. Jpn J Cancer Res. 1989 Dec;80(12):1192-8.
4) Bast RC Jr, et al. 2000 update of recommendations for the use of tumor markers in breast and colorectal cancer: clinical practice guidelines of the American Society of Clinical Oncology. J Clin Oncol. 2001 Mar 15;19(6):1865-78.
5) Tsuda H, et al. Detection of HER-2/neu (c-erb B-2) DNA amplification in primary breast carcinoma. Interobserver reproducibility and correlation with immunohistochemical HER-2 overexpression. Cancer. 2001 Dec 15;92(12):2965-74.
6) Tsuda H, et al. Evaluation of interobserver agreement in scoring immunohistochemical results of HER-2/neu (c-erbB-2) expression detected by HercepTest, Nichirei polyclonal antibody, CB11 and TAB250 in breast carcinoma. Pathol Int. 2002 Feb;52(2):126-34.
7) Kunitomo K, et al. Detection of c-erbB-2 (HER-2/neu) amplification in breast carcinoma by fluorescence in situ hybridization on tissue sections and imprinted cells. Pathol Int. 2002 Jul;52(7):451-7.
8) 胃がんHER2検査病理部会. HER2検査ガイド-ハーセプチンの適正な症例選択のために- 胃がん編 第三版. 2014年7月改訂.
関連製品
・コード:417091 ヒストファイン HER2コントロールスライド
・コード:715281 HEAT PROCESSOR Solution pH6

食道